En entradas anteriores hemos analizado las fases iniciales del metabolismo de la glucosa: la glucolisis y la fosforilación oxidativa, junto con los mecanismos de degradación anaerobia y el Ciclo de Krebs. En este paso analizaremos la cadena respiratoria.
La cadena respiratoria es la tercera parte de la degradación
aerobia. En ella, los electrones son llevados hasta el O2 que se oxidará a H2O.
Llevaremos
doce pares de elecrones: dos de ellos provienen de la glucolisis, otros dos de
la decarboxilación oxidativa y los ocho pares restantes provienen del Ciclo de
Krebs.
Es
decir:
Glucolisis:
- 2 NADH
Decarboxilación
oxidativa:
- 2 NADH
Ciclo
de Krebs:
- 6 NADH
- 2 FADH2
La
cadena respiratoria es el conjunto de compuestos, incluidos en la membrana
mitocondrial interna, que son transportadores de electrones. Hay entre doce y
quince (no se conoce exactamente su número). Todos ellos están asociados a
proteínas. Y todos excepto el Citocromo 6 son hidrófobos, es decir, están en
proteínas integrales de membrana.
Coenzimas:
NAD, FAD y FMN.
CoQ + 2 H → CoQH2
Citocromos:
son hemoproteínas con un hierro. Se conocen varios citocromos: b, c1 c, a y a3.
La c es hidrosoluble. El grupo hierro puede sufrir la siguiente reacción, con
el consiguiente trasiego de electrones:
Fe2+ → Fe3+
Los
pares rédox se ordenan según su potencial, primero los más electropositivos. En
cada reacción el primer componente se oxida y el otro se reduce. Esto va
pasando de uno a otro, en cadena, hasta llegar al O2.
 |
| Pares rédox |
En
el complejo III están los dos tipos de citocromo b. Y en el complejo I hay al
menos cuatro proteínas hierro-azufre. Es decir, el esquema está simplificado.
Los
complejos tienen su nombre concreto:
- El complejo o grupo I se denomina NADH-Coenzima Q reductasa.
- El complejo o grupo II se denomina Succinato-Coenzima Q reductasa.
- El complejo o grupo III es el Coenzima QH2-Citocromo C reductasa.
- El complejo o grupo IV se denomina Citocromo C oxidasa.
La
aubiquinona y el citocromo C son independientes.
La
ubiquinona es un punto de entrada de electrones que proviene de otros enzimas
que transportaron electrones de otras vías. El FADH2 puede entrar por otros
sitios.
El
Citocromo C es una proteína periférica, no está integrado en la membrana.
Al
final del proceso:
2 O2 + 2 e- → 2 O2-
2 O2- + 2 H+ → H2O2 + O2
H2O2 → H2O + ½ O2
El
ión O2- se dennomina ión superóxido y es muy tóxico para la célula, por eso
debe ser metabolizado. La segunda reacción es catalizada por la superóxido
dismutasa y su producto, el peróxido de hidrógeno (H2O2) tampoco es un producto
tolerable. Por eso es metabolizado en la última reacción por la catalasa.
Si
sumamos las tres reacciones obtenemos que:
2 O2 + 2 e- + 2 H+ → H2O
En
la reacción total del catabolismo de la glucosa, tenemos que:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
Como
tenemos doce pares de electrones y cada par de electrones necesita ½ O2
necesitaremos 6 O2 quedando por tanto en concordancia con la reacción.
Es
decir:
10 (NADH + H+) + 2 FADH2 + 6 O2 → 10 NAD+ + 2
FAD2+ + 12 H2O
Con
la energía de oxidación por transportar los pares de electrones en la cadena
(en los tres puntos, en los complejos) se nos formará, gracias a la energía
desprendida en cada complejo, ATP a partir de ADP.
Se
trata de una serie de escalones energéticos.
Para
ver estos escalones energéticos, veremos los potenciales. Partimos de los NADH
y FADH2 mitocondriales y los escalones son los diferentes complejos:
 |
| Escala de potenciales |
Cada
NADH mitocondrial, mediante la cadena respiratoria, forma 3 ATP. El FADH2, a
través de la cadena, desprenderá energía para fabricar 2 ATP.
Pero
tenemos un NADH de la glucolisis en el citoplasma que no puede entrar en la
mitocondria directamente. Entrará mediante unas reacciones intermedias llamadas
lanzaderas. Pasa los electrones a otros compuestos que pueden entrar en la
mitocondria.
Hay
lanzaderas de dos tipos: la del glicerol-fosfato, típica del músculo y que
entra a nivel del coenzima Q, con lo que con ese NADH solo se formarán dos ATP.
Y la del malato-aspartato, típica del hígado y que hace entrar un compuesto más
electronegativo en la cadena, con lo que se producirán los correspondientes
tres ATP con el NADH, es decir, se obtiene rendimiento máximo.
Fosforilación oxidativa.
La
cadena respiratoria, el el caso del NADH, se resumiría de la siguiente forma:
NADH + ½ O2 → NAD+ + H2O - ΔGº’ = -52,6
Kcal/mol
Es,
por lo tanto, una reacción muy exergónica.
La
fosforilación acoplada sería:
3 ATP + 3 Pi → 3 ATP + 3 H2O - ΔGº’ = 3*7,3 =
21,9 Kcal/mol
Es
decir, que conseguimos aprovechar casi 23Kcal/mol de las 52,6Kcal/mol que se
generan. El rendmiento es del 41,6%.
La
cadena respiratoria para el FADH2 sería:
FADH2 + ½ O2 → NAD + H2O - ΔGº’ = -43,4
Kcal/mol
La
fosforilación acoplada:
2 ATP + 2 Pi → 2 ATP + 2 H2O - ΔGº’ = 2*7,3 =
14,6 Kcal/mol
Es
decir, que el nivel de aprovechamiento es menor, el 34% en este caso.
Las
686Kcal/mol posibles de la combustión de la glucosa se va acumulando en las
distintas coenzimas. Y tras todo el proceso, la cadena respiratoria para una
molécula de glucosa sería:
10 (NADH+H+) + 2 FAD + 6 O2 → 10 NAD+ + 2 FAD + 12 H2O
ΔGº’ = 10*(-52,6) + 2*(-43,4) = 613 Kcal/mol
Respecto
a las 686Kcal/mol posibles supone un rendimiento del 90%.
En
el caso de la fosforilación oxidativa acoplada (que es la que realmente le dará
energía a la célula), dependerá de si se produce en un sitio u otro, en función
de la lanzadera.
Por
ejemplo, en el músculo:
32 ADP + 32 Pi → 32 ATP + 32 H2O - ΔGº’ =
7,3*32 Kcal/mol = 233,6 Kcal/mol
Los
32 ATP privienen de que 8 NADH mitocondriales generarán 24 ATP (tres cada uno)
y 2 NADH de la glucolisis (citoplasma) generarán 4 ATP (dos cada uno), a los
que sumaremos otros 4 ATP provenientes de 2 FADH2.
En
el caso del hígado en lugar de 32 ATP obtendríamos 34 ATP, ya que los 2 NADH de
la glucolisis generan 3 ATP cada uno en lugar de 2.
Producción de ATP.
¿Cómo
se producen los ATP a partir de la cadena de transporte de electrones? A esta
pregunta responde la teoría quimiosmótica de Mitchell.
Sabemos
que tiene lugar en la mitocondria. La mitocondria posee una membrana interna y
una membrana externa. La membrana externa posee muchas proteínas, constituyendo
hasta el 80% de su peso. Pueden ser de tres tipos:
- Elementos de la caden respiratoria.
- ATP sintetasas.
- Elementos de transporte.
La
membrana interna no es lisa, sino que tiene entrantes y salientes denominados
crestas mitocondriales. El interior de la mitocondria se denomina matriz
mitocondrial. Y el espacio que queda entre la membrana interna y la membrana
externa se denomina espacio intermembrana.
Dentro
de la membrana interna hay una proteína de membrana especialmente abundante, la
proteína Fi.
 |
| Partículas Fi en la membrana interna de la mitocondria |
Los
complejos se encuentran en la membrana interna de la mitcondria de la siguiente
forma:
 |
| Complejos en la membrana interna de la mitocondria. |
En
cuanto a las partículas Fi, serían de la sigueinte forma:
 |
| Partícula FoFi |
La
parte Fo son seis cadenas polipeptídicas de varios tipos, hidrófobas y formando
un canal (es decir, lo que vemos en Fo es un corte en sección, en realidad
tiene forma cilíndrica).
En
la parti Fi hay cinco tipos de plipéptidos, α3, β3, γ, θ y ε.
En
la mitocondria hay un sistema de transporte específico. Solo entra por si mismo
el O2 y solo sale por si mismo el CO2. El resto de compuestos necestan
transportadores. Se trata de una membrana muy impermeable.
Según
la teoría de Mitchell la cadena de transporte electrónico va a utilizar su
energía de oxidación para transportar protones (H+) en contra de su gradiente
de concentración, desde la matriz hasta el espacio intermembrana. Es decir, se
comportará como una bomba de protones.
Estos
protones pasarán a nivel de la NADH-Q reductasa, a nivel de la QH2-Citocromo C
reductasa y a nivel de la Citcromo C oxidasa. Como consecuencia de este
transporte se va a formar un gradiente electroquímico de protones que tendrá
como componentes un gradiente de voltaje (ΔΨ) y un gradiente de concentración
que, al tratarse de un gradiente de protones, se traducirá como un gradiente de
pH (ΔpH).
El
conjunto de estos dos gradientes se le conoce como fuerza protónmotora o fuerza
protónmotriz, rigiéndose por la siguiente fórmula:
Sabemos
que ΔΨ rondará los 160mV y ΔpH rondará 1mV. El valor de la pmF rondará los
220mV.
Es
decir, la energía redox es transformada en esto, en una fuerza protonmotriz. Y
esta fuerza es usada para transformar ADP en ATP. De esta transformación se
encarga la parte Fi de la proteína.
Se
debe a que los protones tratarán de entrar en la matriz cmo sea y lo harán por
el canal constituido por Fo. En las esferas (Fi) el flujo, la energía de paso
de esos protones, hace que el ADP se transforme en ATP.
Puede
ser que la transformación se deba a un cambio conformacional de las proteínas
que catalizan la reacción. Pero hay más hipótesis. Otra es que los protones
ayudan a la formación del ATP. Lo que si está claro es que sin el flujo de
protones, el ADP no se fosforila a ATP.
Por
cada dos electrones que se transadan del NADH al oxígeno se traslocan un número
de protones. No se sabe exactamente cuantos. Al volver, al romper el gradiente,
forsforilan un ATP. Y como el trasloque ocurre en tres sitios, hay que multiplicar
por tres, por lo cual por cada NADH se forman 3 ATP.
Sabemos
que, como mínimo, deben pasar dos protones en cada uno, aunque puede que sean
más. Para que todo esto funcione, la membrana interna debe ser impermeable a
los protones. Con todos los elementos orientados, perfectamente cerrada e
intacta. De lo contrario, no se formaría el gradiente.
La
energía química se ha transformado en enegía redox y esta, a su vez, se ha
transformado en la energía de un gradiente de protones. Esta energía se transforma
en la energía del enlace fosfato del ATP, un enlace de alta energía.
Utilizar
el gradiente de protones para formar ATP no es la única función. Puede hacerse
un proceso inverso, creando un gradiente de protones a parter de ATP. Es decir,
puede actuar tanto como ATP sintetasa como ATP-asa. Que funcione d euna manera
u otra depende de que la fuerza protonmotriz del gradiente de protones domine o
que domine la energía de hidrólisis del ATP.
Sabemos
que:
Si
dominase la segunda opción, se bombearían protones hacia el otro lado. En
condiciones normales lo que ocurre es que el ATP sale da la matriz por medio de
su correspondiente permeasa, de forma que nunca se acumula y por lo tanto nunca
sobra.
Todo
esto está sometido a regulación. Está ajustado a las necesidades de ATP. Aquí
el factor determinante es el ADP. Además, está acoplada. La cadena respiratoria
y la fosforilación oxidativa no funcionan la una sin la otra.
Si
tenemos NADH y suficiente O2 (si no hay estos dos componentes no puede
funcionar la cadena) pero no hay ADP, el sistema no funciona. No solo deja de
funcionar la ATP sintentasa, deja de funcionar toda la cadena. La modulación
que lo regula es el propio gradiente de protones. El gradiente de protones
estimula la actividad de la ATP sintetasa e inhibe la cadena respiratoria. Si
tenemos poco ATP en el medio, aumenta la concentración de ADP, aumenta el
sustrato de la ATP sintetasa. El equilibrio se desplaza a la erecha. Se deshace
el gradiente de protones. Y esto estimula la cadena respiratoria.
Hay
factores o agentes químicos que producen desajustes en estos procesos.
Cualquier factor que haga que se desajuste o desacople el gradiente, por
ejemplo, estropeará la cadena. Por ejemplo, si la membrana se hace permeable a
los protones. Desarticula todo el sistema, la ATP sintetas deja de funcionar y
sin embargo la cadena respiratoria no deja de funcionar, sino que se activa aun
más, ya que no hay gradiente, lo cual la excita, la empuja a trabajar más
deprisa. Esto ocurre, por ejemplo, cuando se rompe la membrana.
La
energía del gradiente de protones se utiliza también en otras estructuras
celulares. Por ejemplo, en los cloroplastos. Y en las bacterías se produce un
gradiente semejante, en esta ocasión del exterior respecto del interior de la
propia bacteria. La cadena respiratoria se encontraría en la membrana exerna. Y
las ATP-asas de las bacterias se encuentran también en una posición
equivalente.
 |
| Gradiente de protones en bacterias |
En
la mitocndria, en la bacteria y en el cloroplasto se produce ATP. En la
mitocondria, además, transporta fosfato mediante un sistema de cotransporte del
fosfato con los protones (los protones arrastran a los fosfatos).
También
hay ransportes para el calcio (Ca2+). De hecho hay dos transportes, uno de
entrada y uno de salida. El transporte hacia el interior se lleva a cabo por
medio de diferencia de cargas. El de salida es una bomba de intercambio con
los protones.
Existe
un intercambio de ADP y ATP. El ATP sale y el ADP entra. El interior es más
negativo y en este intercambio metemos tres cargas negativas del ADP (ADP3-) y
secamos cuatro cargas negativas del ATP (ATP4-), siendo por lo tanto un
intercambio favorable.
En las
bacterias existe una turbina de protones, que hace que se muevan los flagelos
bacterianos. La energía viene dada por el gradiente de protones.
 |
| Bomba de protones en el flagelo de procariotas |
El resumen final de todo el consumo de glucosa sería como sigue:
Glucólisis:
Glucosa + 2NAD + 2(ADP+PI) → 2 Piruvato + 2(NADH + H+) +
2H2O + 2ATP
Descarboxilaicón
oxidativa:
2Piruvato+ 2CoA-SH + 2NAD → 2AcetilCoA + 2(NADH + H+) +
2CO2
Ciclo
de Krebs:
2AcetilCoA + 6NAD + 2FAD + 2(ADP+PI) + 4H2O →
6(NADH+H+) + 2FADH2 + ATP + 4CO2
Cadena
respiratoria:
10(NADH + H+) + 2FADH2 + 6O2 → 10NAD + 2FAD + 12H2O
Fosforilación
oxidativa:
32(ADP + Pi) → 32(ATP + H2O)
Si
sumamos todos los procesos, obtenemos que:
Glucosa + 6O2 + 36ADP + 36Pi → 6CO2 + 36ATP + 42H2O
ΔGº=-686 + (7,3x36)
Glucosa + 6O2 → 6CO2 + 6H2O - ΔG=-686
36ADP + 36Pi → 36ATP + 36H2O -
ΔGº=262,8Kcal/mol
Rendimiento: 38,3% (en el músculo).
 |
| Resumen del catabolismo aeróbico de la glucosa |
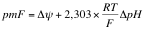


No hay comentarios:
Publicar un comentario